1. Action de réduire quelque chose, d’en diminuer la valeur, le nombre, la quantité, l’importance : Une réduction de personnel. 2. Quantité dont quelque chose est réduit et, en particulier, diminution opérée sur un prix : Consentir une réduction à un acheteur.
Mais encore, Comment reconnaître une réaction de réduction ? Une réaction chimique est qualifiée de réaction d’oxydo-réduction si elle fait intervenir des échanges d’électrons entre les réactifs. Certains réactifs reçoivent donc des électrons tandis que d’autres en cèdent ce qui implique la présence d’ions parmi les espèces qui participent à la réaction.
Comment faire une réduction en français ?
Prenons par exemple un produit à 20€ :
- Si la remise est de -50%, le plus simple est de diviser par 2 soit 20€/2 = 10€
- Si la remise est de -60%, le plus simple est de multiplier par 40 puis diviser par 100 soit 20€ x 40 = 800€ /100 = 8€
- Si la remise est de -75%, le plus simple est de diviser par 4 soit 20€/4= 5€
Encore, Quel est le synonyme du mot réduction ? abattement, baisse, décharge, décompte, déduction, dégrèvement, discount, escompte, rabais, remise, ristourne.
De plus, Comment faire une réduction en math ? Définition : Agrandir ou réduire une figure, c’est construire une figure de même forme en multipliant les longueurs de la figure initiale par un nombre k strictement positif. Exemple: Soit un carré de côté 3 cm. a) Agrandir ce carré dans le rapport 1,2. → Le carré agrandi aura pour côté 3 cm × 1,2 = 3,6 cm.
Qu’est-ce qu’une réaction d’oxyde do réduction ?
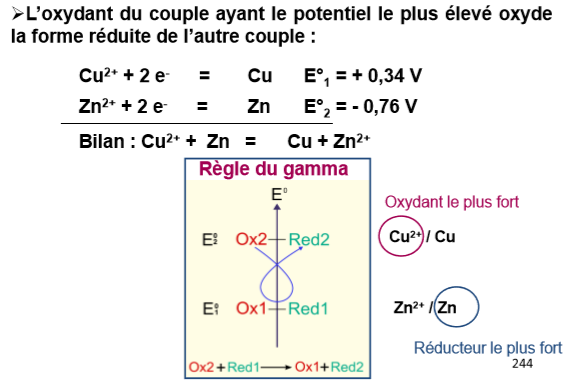
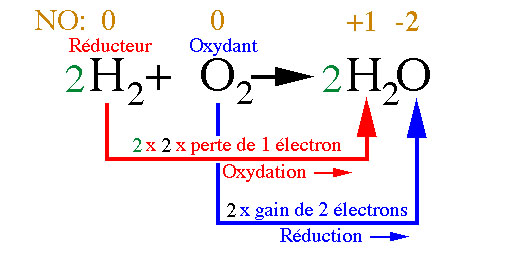
Une réaction d’oxydoréduction ou réaction redox est une réaction chimique au cours de laquelle se produit un transfert d’électrons. L’espèce chimique qui capte les électrons est l’oxydant et celle qui les cède, le réducteur.
Comment identifier les réactifs ?
Les éléments présents en début de réaction sont les réactifs. Les éléments présents en fin de réaction sont les produits.
Qui subit une oxydation ?
Un élément subit une oxydation lorsqu’il perd un ou plusieurs électrons. Un élément subit une réduction lorsqu’il gagne un ou plusieurs électrons. Une espèce chimique contenant un élément qui subit une oxydation est dite « oxy- dée ».
Comment calculer moins 20% ?
Exemple : 100 € – (100 € * 20 / 100) = 80 € : pour 20% de réduction.
Comment faire une remise de 10% ?
Si vous voulez calculer la remise de 10 % pour un achat de 120 € par exemple, vous devez multiplier 120 € par 0,1. Le montant de la remise est de 12 euros soit un prix de l’article après remise qui est de 108 € (120€ -12€).
Comment calculer une réduction de 30% ?
Dans ce cas, on va simplement effectuer un produit en croix classique. Multipliez alors le pourcentage de solde par le prix affiché et divisez le résultat par 100. Dans notre exemple, cela donne le calcul suivant : 30*69/100 = 20,70. On retrouve donc le montant de la réduction.
Quel est le contraire de réduction ?
amoindrissement, décroissement, raccourcissement, rétrécissement; anton. accroissement, augmentation, croissance, extension.
C’est quoi une remise commerciale ?
Une remise est une réduction commerciale habituelle accordée en fonction des quantités achetées, dans le cadre d’une opération promotionnelle ou suivant la qualité du client. Généralement, ces remises sont accordées aux clients qui achètent des quantités importantes.
Qui a du génie synonyme ?
Mots croisés
Esprit savant. Grand talent. L’art des ingénieurs.
Comment calculer une réduction d’une figure ?
Agrandissement et réduction
On dit que la figure a été réduite d’un rapport k, si toutes les longueurs de la figure ont été multipliées par k et k<1. Propriété 1 : Si une figure a été agrandie ou réduite d’un rapport k, alors les aires de la figure sont multipliées par k² et le volume par k³.
Comment trouver la réduction d’une figure ?
Exemple : Le triangle DEF est une réduction du triangle ABC. Calculer DE et EF. Le coefficient de réduction est égal à DF AC = 1, 8 3, 6 = 0, 5. Donc, DE = 0, 5 × AB = 0, 5 × 2=1cm, et EF = 0, 5 × BC = 0, 5 × 4=2cm.
Comment calculer une réduction de rapport ?
Définissez la méthode de calcul: rapport de réduction = vitesse d’entrée ÷ vitesse de sortie.
Comment reconnaître un oxyde ?
On utilise les suffixes -eux et -ique pour distinguer les deux nombres d’ oxydation d’un même métal:
- le suffixe -eux indique le nombre d’ oxydation le plus bas;
- le suffixe -ique indique le nombre d’ oxydation le plus élevé.
Quel est l’oxydation ?
oxydation
1. Réaction chimique, souvent provoquée par l’oxygène, par laquelle on retire des électrons à un atome ou à une molécule. (L’opération opposée est la réduction.)
Comment déterminer le nombre d’oxydation ?
Pour déterminer le nombre d’oxydation d’un atome dans une espèce chimique, on retiendra les quelques règles qui suivent : Isoler les espèces chimiques covalentes.
Exemple :
- Cr 3 + : n.o. = + III.
- : n.o. = 0.
- Cr 2 O 7 2 − : 2 n.o + 7 x (-2) = – 2 d’où : n.o. de Cr : + VI.
- H 2 O 2 : n.o. de O = – I (cf. exceptions)
Comment trouver les réactifs et les produits ?
Dans un bilan de réaction, les réactifs se trouvent à gauche de la flèche, les produits sont à droite.
Quelles sont les réactifs ?
Lors d’une réaction chimique, un réactif est une espèce chimique, présente dans le milieu réactionnel, dont la concentration tend à diminuer au cours du temps : les réactifs sont consommés, leurs atomes se réarrangent pour former de nouvelles molécules : les produits de cette réaction.
Quels sont les différents réactifs ?
Dans une réaction de synthèse, les réactifs peuvent être :
- deux éléments ;
- un élément et un composé ;
- deux composés.
Comment appelle On couramment l’oxyde de fer ?
L’oxyde de fer(III), également appelé oxyde ferrique et sesquioxyde de fer, est le composé chimique de formule Fe2O3, où le fer a le nombre d’oxydation +III.
Qu’est-ce que l’oxydation d’un matériau ?
Réaction chimique où une molécule perd un ion ou un électron. Cette réaction est utilisée en traitement des eaux, où on ajoute un agent oxydant (ozone, eau oxygénée, hypochlorite de sodium, permanganate de potassium, etc.) pour éliminer les molécules dangereuses.